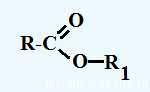
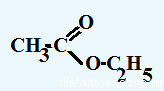
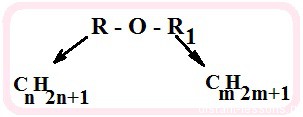
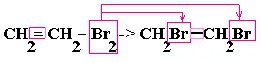
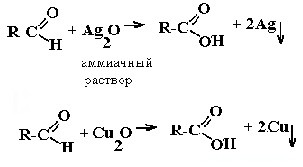
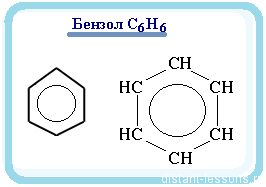
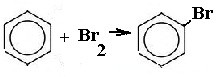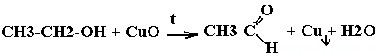Окислительно-
восстановительные реакции
- предсказание продуктов и уравнивание методом полуреакций.
Давайте рассмотрим следующие реакции:
1. Перманганат и нитрит калия в серно-кислой среде;
2. Перманганат калия и хлорид железа (II) в соляно-кислой;
3. Перманганат калия и нитрит калия в нейтральной среде.
2. Перманганат калия и хлорид железа (II) в соляно-кислой;
3. Перманганат калия и нитрит калия в нейтральной среде.
1. Перманганат и нитрит калия в серно-кислой среде:
Перманганат калия - один из самых сильных окислителей. В кислой среде восстанавливается до Mn2+, а нитрит калия будет окисляться до нитрата NO3-
Перманганат калия - один из самых сильных окислителей. В кислой среде восстанавливается до Mn2+, а нитрит калия будет окисляться до нитрата NO3-